 צילום: בלומברג
צילום: בלומברג
חקיקה בארה"ב תחסוך מיליוני דולרים לחברות ביומד ישראליות
הקונגרס האמריקאי אישר חוק שיאפשר לחברות ביומד שמפתחות טיפולים רפואיים חדשניים לבצע ניסוי קליני מצומצם בשלב השלישי כדי לזרז את הגעת התרופות לשוק. בין החברות שצפויות ליהנות: קייט פארמה, בריינסטורם, בונוס וקדימהסטם
חוק חדש שאושר השבוע בקונגרס האמריקאי (21th Century Cures Act) מהווה הזדמנות לקידום מהיר של טיפולים רפואיים חדשניים. האישור נוגע למספר חברות ישראליות שפועלות בתחום הביומד, בהן בריינסטורם, פלוריסטם, קייט פארמה, סלקט, גמידה סל, בונוס ביוגרופ וקדימהסטם. החוק מאפשר לחברות לקצר ולהאיץ את הליכי האישור של הטיפולים שהן מציעות ובכך לחסוך מאות מיליוני דולרים.
קראו עוד בכלכליסט
החוק יתמוך בעיקר ברפואה רגנרטיבית, תחום מחקר שמתמקד בריפוי מומים באמצעות יצירת איברים או רקמות חדשות, ובתרפיה תאית, כלומר חברות שעוסקות בתחום תאי הגזע. סוכנות של מחלקת הבריאות בממשלת ארה"ב (ׁNIH), שאחראית על המחקר הביו־רפואי, תקבל תקציב של 4.8 מיליארד דולר למשך עשר שנים. הסוכנות תשתמש בתקציב זה כדי לעזור לחברות שמבצעות ניסויים קליניים.
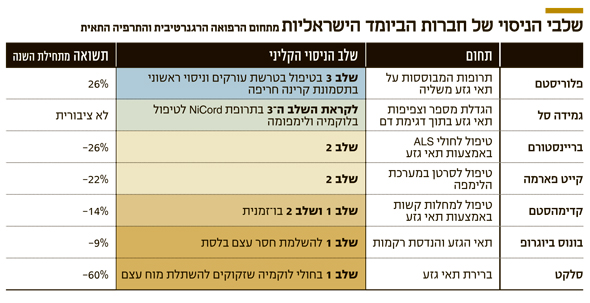
שלב 3 הוא היקר ביותר
ישנם שלושה שלבים עיקריים בתהליך פיתוח טיפול חדש לפני שהוא מאושר לשימוש על ידי ה־FDA. השלב הראשון בניסוי הקליני בודק כיצד הטיפול משפיע על עשרות בודדות של מטופלים, שמקבלים אותו במינונים קטנים. שלב זה בודק בעיקר את תופעות הלוואי, את בטיחות השימוש במוצר ואת פיזור החומר בגוף. עלויות השלב מסתכמות במיליוני דולרים בודדים.
בשלב השני, שכולל מאות חולים ונמשך כשנתיים, בוחנים את השפעת הטיפול על המחלה הנבדקת ומידע בטיחותי נוסף, בעיקר השפעות שליליות ארוכות טווח. עלויות השלב יכולות להגיע לעשרות מיליוני דולרים. אם הטיפול נמצא יעיל לשימוש והסיכונים בו נסבלים, עוברים לשלב השלישי, שנבחן על מספר גדול של מטופלים (בדרך כלל מדובר באלפי חולים). שלב זה הוא הארוך והיקר ביותר ובו בודקים בעיקר את יעילות התרופה אל מול טיפול קיים, במידה וישנו. בתום השלב השלישי החברה יכולה להגיש את המוצר לאישור ה־FDA.
כעת, על פי החוק החדש, חברות שעוסקות ברפואה רגנרטיבית ובתרפיה תאית יבצעו רק ניסוי קליני מצומצם בשלב השלישי והמכריע. בנוסף, חברות שמפתחות טיפול למחלות חסרות מענה רפואי, יצטרכו להראות רק הוכחת יעילות, בדומה להקלות שקיימות היום לחברות שמפתחות תרופות לאיידס ולסרטן.
"החוק החדש שאושר בקונגרס מיועד בדיוק לחברות מסוגה של בריינסטורם, מאחר והוא בא לתת מענה לחולים קשים אשר אין להם זמן להמתין לתהליך האישור הארוך שהיה עד כה", הסביר ל"כלכליסט" מנכ"ל החברה חיים לייבוביץ'. "המחוקק הבין שלחולים במחלות סופניות, שאין להם מענה טיפולי, צריך לתת גישה למוצרים מתקדמים במהירות רבה יותר". בבריינסטורם מקווים שבעזרת החקיקה החדשה החברה תוכל להציע בהקדם האפשרי טיפול מאושר לחולי ניוון שרירים (ALS). ביולי האחרון דיווחה בריינסטורם על הצלחת ניסוי קליני שלב 2, שנערך בארה"ב, במוצר הדגל NurOwn. בשלב הבא בריינסטורם צפויה להתחיל בניסוי בהזרקה רב פעמית של תאי גזע לחולים, זאת כדי לבדוק את פוטנציאל היעילות של הטיפול על החולים לאורך זמן.
"ככל שאוכלוסיית העולם המפותח הולכת ומזדקנת, גובר הצורך לטיפול במחלות בהן לא ניתן לטפל בצורה יעילה בתרופות ביולוגיות וכימיות. זו הסיבה שההצעה הנוכחית עלתה לדיון בסנאט האמריקאי", אמר ל"כלכליסט" מנכ"ל קדימהסטם יוסי בן יוסף. "תרפיה תאית ורפואה רגנרטיבית מציעות אלטרנטיבה יעילה וחדשנית לטיפול במחלות חשוכות מרפא". קדימהסטם מפתחת טיפולים מבוססי תרפיה תאית שמקורם בתאי גזע למחלות קשות, בעיקר במחלת ה־ALS שבה החולים מתים בתוך 5-3 שנים. החברה כבר נהנית מחקיקה ותקנות רגולטוריות דומות שקיימות במדינות ברחבי העולם, בהן דרום קוריאה. לאחרונה הודיעה קדימהסטם על שיתוף פעולה רחב עם חברה קוריאנית בתחום הרפואה התאית, שזכתה להקלות מהרשויות המקומיות ומטפלת בחולי ALS לאחר ביצוע ניסויים ראשונים בבני אדם בלבד.
"הצעת חוק מהפכנית"
חברה נוספת שצפויה ליהנות מהחוק היא פלוריסטם, שמפתחת תרופות שמבוססות על תאי גזע משליה. פלוריסטם מאמינה כי התרופות שלה יענו על הקריטריונים הנדרשים במסגרת החוק, דבר שעשוי להקדים את הגעתן לשוק האמריקאי כבר ב־2017. תכנית הפיתוח הקלינית של החברה, בניהולו של זמי אברמן, לטיפול במחלת טרשת העורקים החמורה בגפיים התחתונות (CLI) נמצאת במסגרת מסלולי אישור רגולטוריים מואצים באירופה וביפן. בנוסף, בימים אלה נערך ניסוי לקראת הגשת בקשה לאישור FDA טיפול בסינדרום הקרינה האקוטית של החברה.
״מדובר בהצעת חוק מהפכנית שתסייע רבות בתהליכי רגולציה ותאיץ את ההגעה לשוק אצל חברות רבות, לרבות בונוס ביוגרופ שעונה על הקריטריונים הנדרשים", הסביר ל"כלכליסט" ד״ר שי מרצקי, מנכ״ל בונוס ביוגרופ שעוסקת בפיתוח, ייצור והשתלת רקמות אנושיות. "המוצר של בונוס הוכח כבר בניסויים קליניים, כך שמלכתחילה המסלול הרגולטורי היה מקוצר. אך מסלול זה יתקצר אף יותר אם החקיקה תעבור בסנאט האמריקאי".
גם קייט פארמה, שמפתחת טיפול לסרטן במערכת הלימפה, צפויה ליהנות מרוח גבית חיובית בעקבות המהלך. החברה, בניהולו של ד"ר אריה בלדגרין, פועלת בתחום תרופות אימונו תרפיה (CAR) ולאחרונה פרסמה תוצאות מוצלחת בניסוי שלב 2 בתרופה KTE-C19 לסרטן במערכת הלימפה. חברת נוספת היא סלקט ביומד, שפועלת בתחום תאי הגזע ומפתחת טכנולוגיה שמאפשרת ברירת תאי גזע בסינון תפקודי.
בפברואר השנה קיבלה סלקט אישור ועדת האתיקה לניסוי קליני שלב 1 בחולי לוקמיה בבית החולים רמב"ם. מדובר בניסוי ראשון מסוגו בחולי לוקמיה שזקוקים להשתלת מוח עצם. החברה הישראלית האחרונה שעשויה ליהנות מהחוק היא גמידה סל, שפועלת בתחום תאי הגזע בעיקר בחולים במחלות דם ממאירות. לחברה מוצר בשם NiCord שנמצא לקראת ניסוי שלב 3.

לא התפרסמו תגובות לכתיבת תגובה